受託分析メニュー
メニューボタンをクリックすると、各詳細が表示されます。
血中異常細胞
血中異常細胞の受託解析
当社では、血中循環がん細胞(CTC : Circulating Tumor Cell)などを含む血中異常細胞の解析を受託しています。
独自の細胞検出チップと誘電泳動による技術で、血中異常細胞の検出からがん関連遺伝子変異解析までを一貫して実施します。
血中異常細胞とは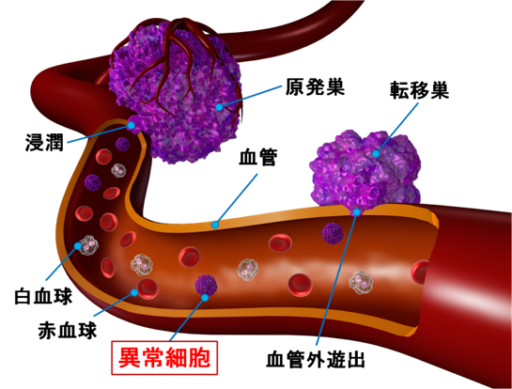
血液中に存在する血液細胞以外の細胞で、がんの原発巣から遊離・浸潤したがん細胞、CTC等を含みます。これらの細胞は、がんの転移に関わっている可能性があり、治療効果の確認等への利用1)や、低侵襲なリキッドバイオプシーとして注目されています2)。
当社では、血液中に存在する抗CK(サイトケラチン)抗体陽性細胞と陰性細胞を検出しますが、CK陰性細胞はがん細胞とは断定できないため、これらの細胞を総称して「血中異常細胞」と呼んでいます。
1) K. Pantel, RH. Brakenhoff, B. Brandt, Nat. Rev. Cancer , 8, 329(2008)
2)C. Alix-Panabieres, K.
Pantel,Clin. Chem ., 59, 110(2013)
血中異常細胞解析技術
通常血液は、細胞成分と液体成分(血漿)、タンパク質などから成っています。細胞成分には主に赤血球、白血球、血小板などが含まれますが、固形がんなどの疾患があると腫瘍由来の細胞が血管内に侵入することがあります。血中に移動した細胞ががん細胞の場合、血管を通じて他の臓器へ生着することにより、がんの転移が生じます。また、このようながん細胞は悪性度が高く、上皮細胞由来であっても、上皮間葉転換(EMT:Epithelial-mesenchymal
transition)と呼ばれる現象が起こることは珍しくありません。EMTを起こした細胞は上皮細胞の特徴が失われCKのような上皮マーカーでの検出は難しくなります。
当社では、2010~2014年度にNEDO(新エネルギー・産業技術総合開発機構)が実施したプロジェクト「血液中のがん分子・遺伝子診断を実現するための技術・システムの研究開発」において東ソー株式会社が開発した細胞解析システムを導入し、高感度な解析技術で血液中のCK陽性およびCK陰性細胞を測定します。

受託分析項目
- 血中異常細胞数測定
- CK陽性細胞
- CK陰性細胞(大径)
- がん関連遺伝子変異解析
分析方法
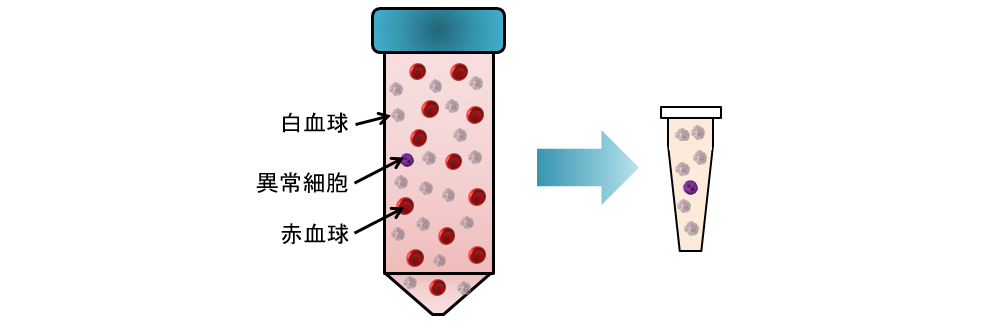
血液中の血球成分を取り除き、血中異常細胞を濃縮します。
細胞濃縮液を細胞検出チップへ導入し、誘電泳動技術を用いて、細胞を微細孔内に固定、整列します。
その後、蛍光標識した抗CK抗体で検出し、CK陽性細胞およびCK陰性細胞数の測定を行います。
血中異常細胞の濃縮
血液サンプルは、溶血試薬によって赤血球を除去し、磁性ビーズにより白血球を吸着除去して血中異常細胞を濃縮します。
臨床データ
前立腺がん患者のモニタリング結果
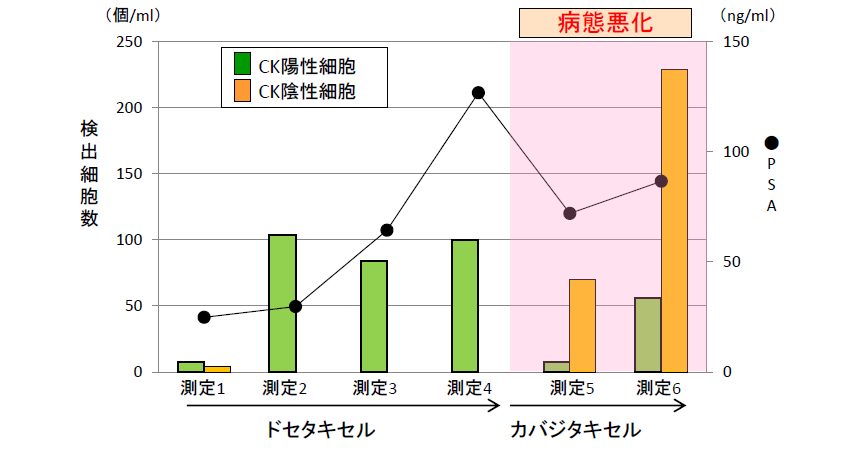
モニタリング開始から病態悪化に伴いPSA値、CK陽性細胞数ともに上昇傾向を示しました
(測定1-3)。抗がん剤変更後(測定4-5)、PSA値は一時的に下降しましたが、画像検査上は病態悪化を示し、CK陰性細胞数の上昇がみられました。
CK陰性細胞は、PSAと比較して早期に病態悪化を検出できる可能性を確認しました。
回収細胞の遺伝子変異解析
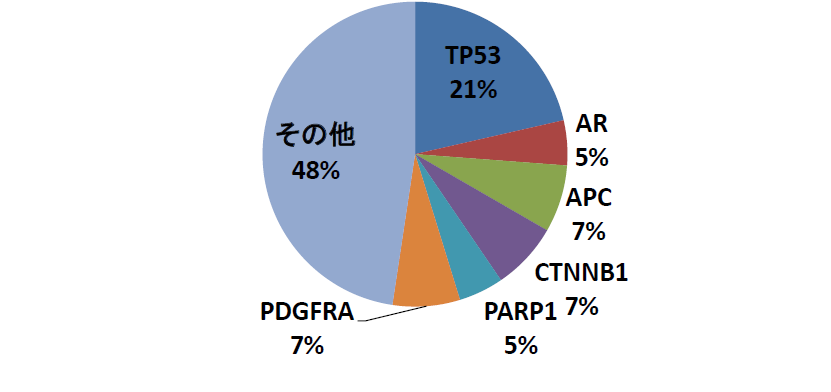
臨床検体より回収された細胞のがん関連遺伝子変異解析を行いました。体細胞変異解析では、TP53遺伝子の変異が多く検出されました。特に、ナンセンス変異やミスセンス変異などの機能喪失に繋がる変異が多数見られました。
*白血球との比較による体細胞変異解析は納品物に含まれません。
データ提供元:東ソー株式会社および杏林大学
関連資料
-
-
High-Density Dielectrophoretic Microwell Array for Detection, Capture, and Single-Cell Analysis of
Rare Tumor Cells in Peripheral Blood.Morimoto A, Mogami T, Watanabe M, Iijima K,
Akiyama Y, Katayama K, Futami T, Yamamoto N, Sawada T, Koizumi F, Koh Y.
PLoS One. 2015 Jun 24
PMID:26107884
-
Diversity of circulating tumor cells in peripheral blood: Detection of heterogeneous BRAF mutations
in a patient with advanced melanoma by single-cell analysis.Kiniwa Y, Nakamura K, Mikoshiba A, Akiyama Y,
Morimoto A, Okuyama R.
J Dermatol Sci. 2018 May;90(2)
PMID:29426605
-
-
- Single-Cell Analysis of Circulating Tumor Cells from Patients with Colorectal Cancer Captured with a
Dielectrophoresis-Based Micropore System.
Nomura M, Miyake Y, Inoue A, Yokoyama Y, Noda N, Kouda S,
Hata T, Ogino T, Miyoshi N, Takahashi H, Uemura M, Mizushima T, Doki Y, Eguchi H, Yamamoto H.
Biomedicines. 2023 Jan 13;11(1):203.
PMID:36672711
- Single-Cell Analysis of Circulating Tumor Cells from Patients with Colorectal Cancer Captured with a
細胞解析用 分析試験依頼書はこちら
FcRⅢAカラムによる抗体分析・分取
FcRⅢAカラムによる抗体分析・分取
当社では、FcRⅢA分析用カラムを用いた抗体の分析を受託しております。
本抗体分析は、抗体ロット間差分析、抗体産生細胞培養状態のモニタリング等にご活用いただけます。
また、当社オリジナルの大型FcRⅢA分取用カラムによる、各抗体画分の大量分取を受託しております。
FcRⅢAカラムによる抗体分取は、高ADCC活性を示す抗体画分のみを分取したり、特定の糖鎖を持つ抗体画分を分取することが可能です。
大型の分取用カラムは、内径が分析用カラムの約5倍で、1回で4,000μgを超える抗体を注入し、大量に分取することが可能です。
FcRⅢAカラムとは
- 3型Fc受容体(FcγRIIIa)をリガンドとしたアフィニティーカラム
- N型糖鎖に起因するFc領域の構造変化を認識
- ADCC活性(抗体依存性細胞傷害)が弱い~強い順に抗体を分離
FcRⅢAカラムによる抗体分析・分取
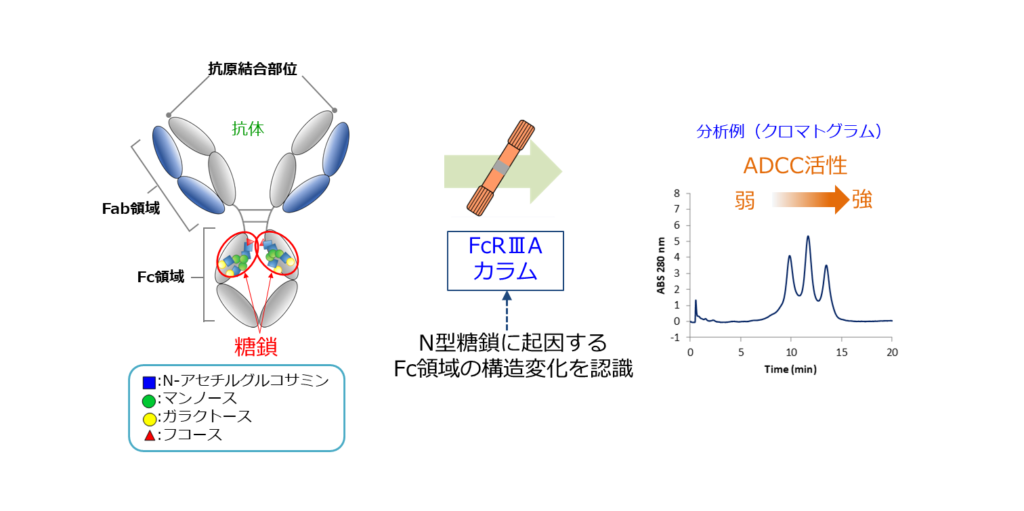
抗体は、Fc領域に結合しているN型糖鎖の違いによりADCC活性が変化します。N型糖鎖の違いに起因する抗体の構造変化を認識するカラムにより、ADCC活性の異なる抗体の分析、分取を行っています。
また、上記で分取した抗体等のN型糖鎖構造解析も行っています。
受託項目
- 抗体分析(FcRⅢAカラムによるクロマトグラムの取得)
- 抗体の大量分取(クロマトグラム上の、ご指定いただいた画分の分取)
- FcRカラムで分取した画分のN型糖鎖構造解析
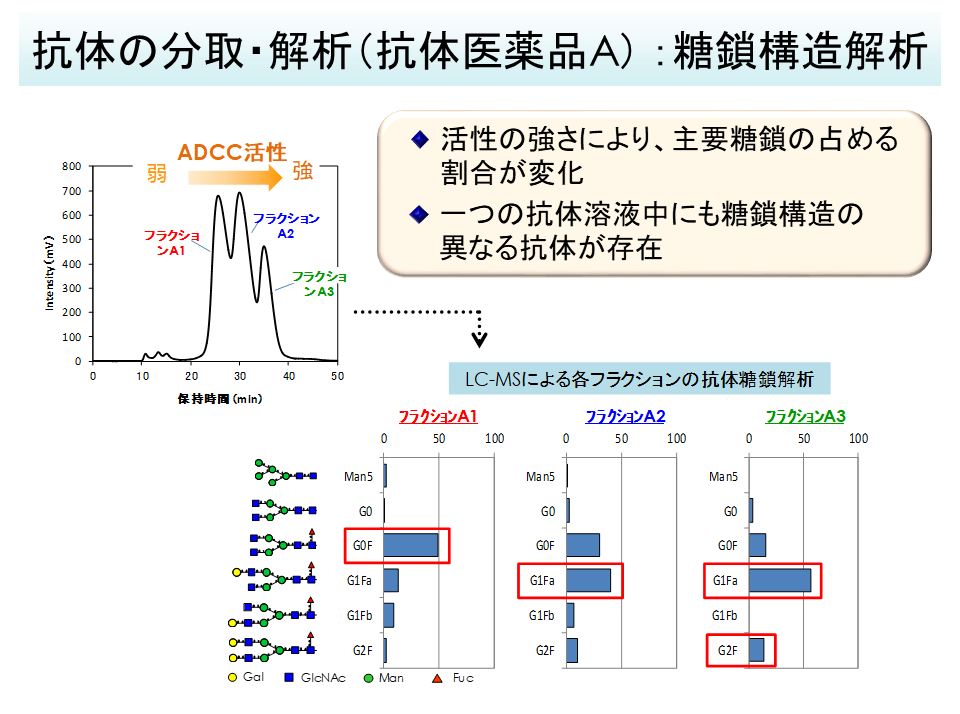
分析例
関連技術資料
糖鎖構造解析
MSによる糖鎖構造解析
LC-MS、MALDI-TOF/MSを用いて、インタクト抗体、N型糖鎖構造解析を受託しております。
インタクト抗体の糖鎖構造解析
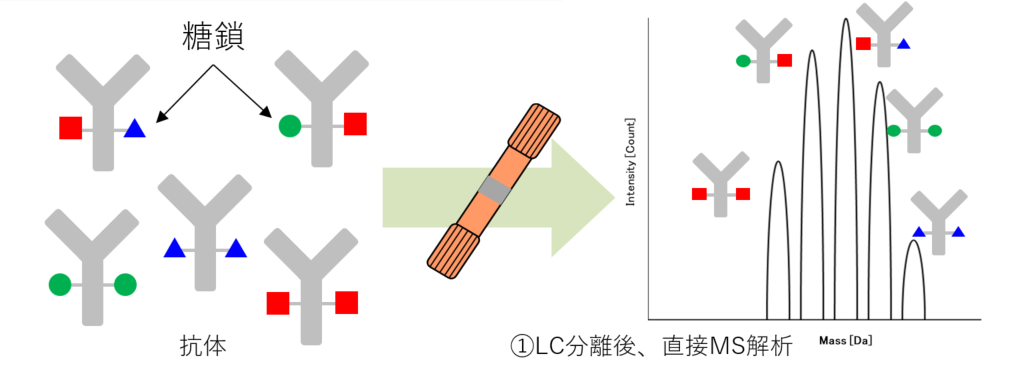
糖鎖が結合した状態の抗体を測定し、結合糖鎖の組合せを解析いたします。
受託項目
- LC-MSによるインタクト抗体の糖鎖解析
- FcR-MSによるインタクト抗体の糖鎖解析
関連技術資料
切り出し糖鎖解析
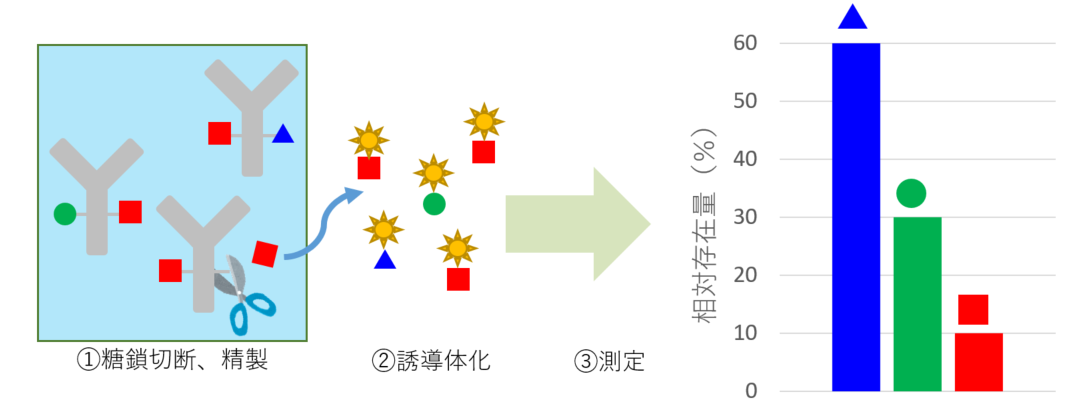
抗体から糖鎖を切り出し、誘導体化した後、糖鎖構造の同定、各組成を測定いたします。
当社では、LC-MS、MALDI-TOF/MSを用いた、N型糖鎖構造解析を受託しております。
本受託解析は、主に抗体Fc領域に結合しているN型糖鎖について解析いたします。
FcRⅢA分取カラムによって分取した抗体中のN型糖鎖、および抗体以外の蛋白質のN型糖鎖につきましても解析が可能です。
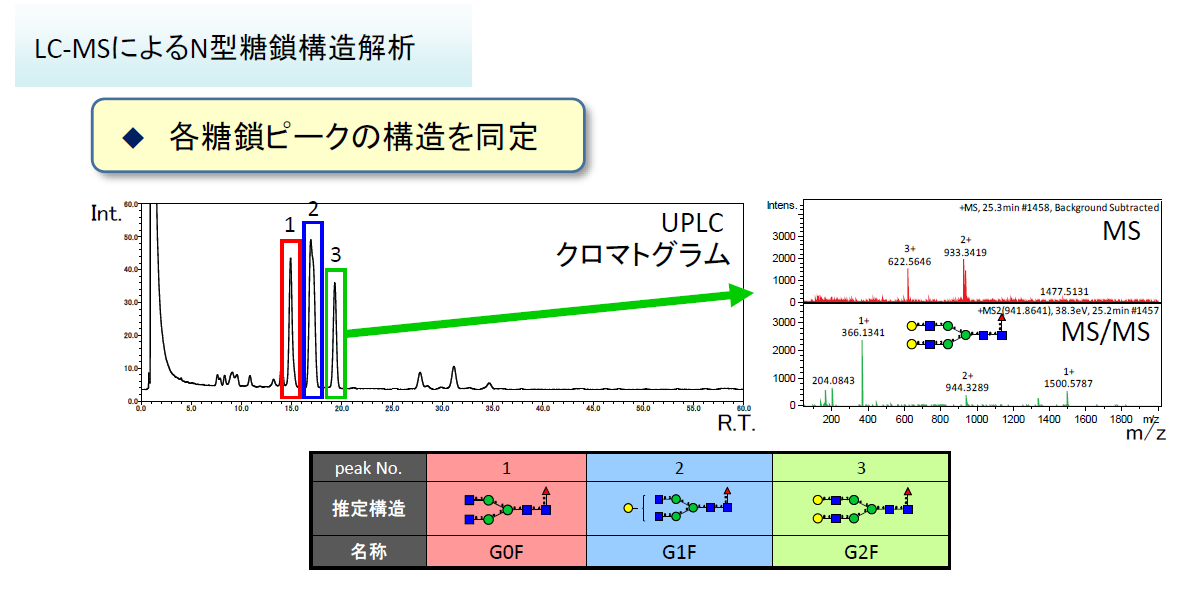
LC-MSでは、糖鎖構造の同定と糖鎖の組成比解析が可能です。
MALDI-TOF/MSでは迅速な糖鎖組成の推定が可能です。
LC-MS、MALDI-TOF/MSによる糖鎖構造解析技術
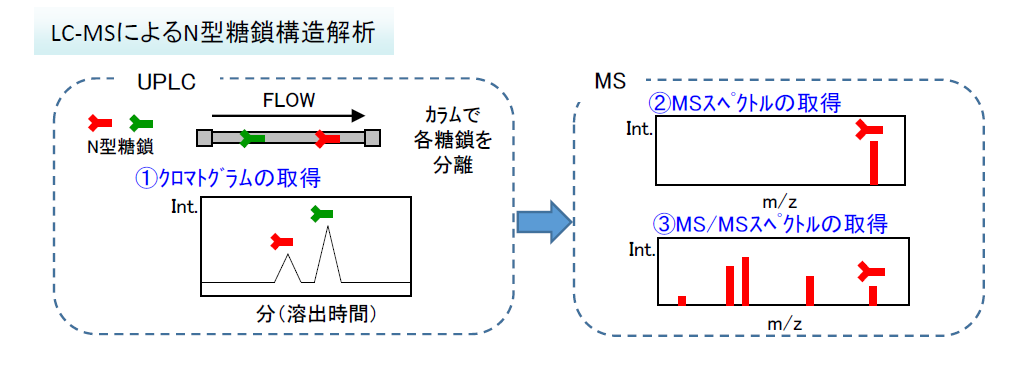
- UPLCにて糖鎖の溶出時間(標準試料で規格化)を取得(①)
- オンラインでMSへ導入し、各糖鎖のMSスペクトル及びMS/MSスペクトルを取得(②,③)
- ①,②,③をデータベースと照合して糖鎖を同定します
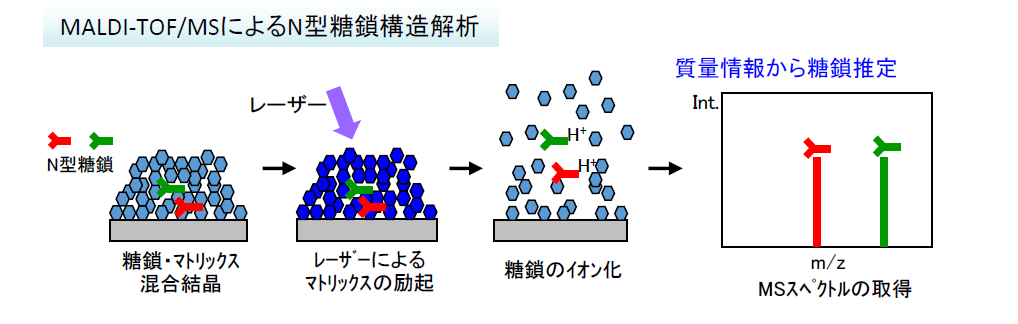
- 糖鎖を混合物の状態で一斉にイオン化し、MSスペクトルを取得します
- 質量情報から単糖の組合せをシミュレートし、糖鎖構造を推定します
分析例
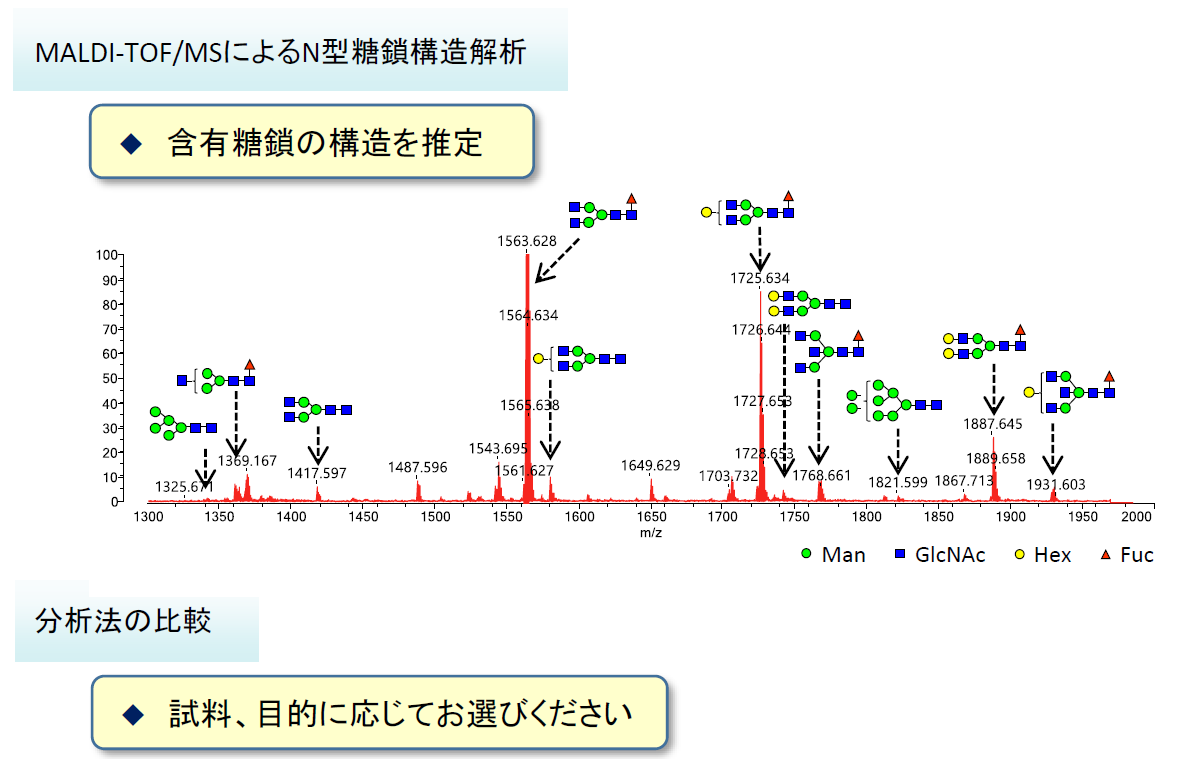
| LC-MS | MALDI-TOF/MS | |
|---|---|---|
| 同定精度 | 高 (位置異性体を区別可) |
低 (位置異性体を区別困難) |
| 定量性 | 有 (UPLCピーク) |
無 |
| 必要糖鎖量 | 1pmol | 10fmol |
| 用途 | 詳細解析 | スクリーニング |
受託項目
- FcRカラムで分取した画分のN型糖鎖構造解析
- LC-MSによるN型糖鎖構造解析
- MALDI-TOF/MSによるN型糖鎖構造解析
- 切り出し糖鎖解析
関連技術資料
NMRによる糖鎖構造解析
高磁場溶液NMRを用いたN型糖鎖の分子構造解析を受託しております。
